磷脂酶固定化载体材料的研究进展
摘要: 游离磷脂酶价格昂贵且稳定性差限制了其应用,固定化技术使酶稳定性增强,可以反复使用,降低了成本,极大地拓宽了酶的应用范围。性能优良的固定化酶应具备成本低、稳定性高和催化活性高等特性。载体材料不仅是固定化酶的重要组成部分,还是影响固定化酶性能的因素之一。对磷脂酶固定化载体材料主要从无机材料、有机材料、复合材料以及无载体 4 个方面进行综述,并对磷脂酶固定化载体材料发展方向予以展望,为固定化磷脂酶研究在载体材料上的选择提供了参考依据。
关键词: 磷脂酶; 固定化; 载体; 材料
磷脂酶是一类存在于生物体内、能水解甘油磷脂的酶,在油脂中发挥重要作用。依据磷脂酶催化磷脂裂解位点的不同分为 5 类: 磷脂酶 A1,磷脂酶 A2,磷脂酶 B,磷脂酶 C 和磷脂酶 D。然而,磷脂酶在自然界中含量低,价格高昂,在酸、碱、热和有机溶剂中不稳定,且难以回收利用,限制了其在工业上的应用。磷脂酶的固定化成为改进这些不足的关键。
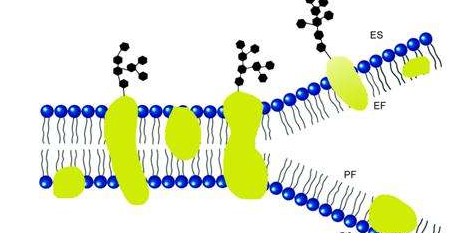
所谓固定化,就是将水溶性酶通过物理或化学方法束缚或者包埋在水不溶性载体中[1]。固定化磷脂酶在保留了磷脂酶特有的高效性和专一性的同时,也提高了磷脂酶的稳定性,极大地降低了成本,工业化操作变得简单,使大规模工业化应用成为现实[2]。
载体不仅是固定化酶的重要组成部分,还是影响固定化酶性能的因素之一[3]。选择适宜的载体有利于提高固定化酶的各种性能。关于载体材料的选择,可以从以下几点考虑: 载体物化性质,如形状、大小、孔径、机械强度、耐酸碱、耐高温和耐生物降解能力等; 载体材料的获得,载体材料廉价易得,是实现大规模工业化应用的关键; 能否再生,对于价格昂贵的载体,再生利用能降低成本,环保节能等。合适的载体材料是酶固定化工艺研究的重点。本文对近几年来磷脂酶固定化载体材料进行了综述并予以展望。
1 无机载体材料
无机材料是指能从自然界直接获取的无机物或者混合其他物质制成的材料。无机材料具备廉价易得、机械强度大、耐酸碱、耐有机溶剂、耐微生物腐蚀等优 点,但无机材料结构难以控制,与 酶 结 合 能力差。
近几年来,为获得理想的无机载体材料,学者们通常会在无机材料表面修饰上活泼的功能基团或者利用新的固定化技术将磷脂酶固定在无机材料上。陶明等[4]使用硅烷偶联剂 KH550 水溶液对无机材料凹凸棒土进行活化,活化后的凹凸棒土用于固定化磷脂酶 A1,显示出较好的酶活回收率和热稳定性。Li 等[5]利用新的固定化技术对磷脂酶进行固定化,先使用 5% 的大豆卵磷脂对磷脂酶 A1 进行生物印迹,再通过无机材料硅藻土对生物印迹后的磷脂酶 A1 固定化,固定化酶在卵磷脂 - 己烷溶液中的活性提高了 30. 9 倍,显著改善了磷脂酶 A1 在有机溶剂中的酶学性质。
新型无机材料也成为固定化磷脂酶的考虑对象。新型无机材料是指近几年开发的具有优异性能的无机材料,如无机纳米材料、介孔分子筛。无机纳米材料具备生物相容性良好、比表面积大等优点而成为固定化磷脂酶的优良载体材料[6]。其中,纳米二氧化硅对大分子物质吸附能力强,且含有功能基团而受到广泛关注。Li 等[7]以纳米二氧化硅为核心,通过吸附、沉淀和化学交联等手段形成“酶网” 覆盖在其表面。固定化酶的酶活约为游离酶酶活的 1. 15 倍。对固定化磷脂酶 D 酶学性质研究表明,与游离磷脂酶 D 相比,固定化磷脂酶 D 的热稳定性明显提高,pH 适应性显著增强,动力学研究表明固定化酶催化活性和酶与底物亲和性增加。在 4 ℃,固定化酶的半衰期为 70 d,约为游离酶的 2. 3 倍。在连续使用 12 批次后,固定化磷脂酶 D 的初始反应速率大于第一批次的 50% ,表明采用该材料固定化的磷脂酶 D 催化活性高,稳定性强。介孔分子筛凭借其内部孔径可调、比表面积大和酶在孔道中易扩散等优点,成为固定化酶载体材料的热点。介孔分子筛已被广泛应用于固定化 β - 葡萄糖苷酶[8]、青霉素 G 酰化酶[9]等,但将其应用于固定化磷脂酶的研究仍处于空白。
2 有机载体材料
有机载体材料是直接利用有机材料或对有机材料进行物理或化学改性制成的材料。有机材料包括天然高分子材料和合成高分子材料两类。
2. 1 天然高分子材料
天然高分子材料来源于自然界中,是一种来源广泛且取之不竭的可再生资源,具有无毒环保、容易改性和生物相容性良好等优点,常被作为固定化酶的载体材料。近年来,常用于磷脂酶固定化的天然高分子材料为天然多糖,如壳聚糖、纤维素和海藻酸钠等。
壳聚糖化学性质稳定,耐热性好,含大量活性基团氨基。孙万成等[10]将壳聚糖、戊二醛与磷脂酶 A1 同时加入反应体系中,使载体、交联剂和酶充分接触,克服了传统方法导致的酶活回收率偏低的缺陷。与此同时,固定化磷脂酶 A1 热稳定性明显提高,pH 向碱性偏移,动力学反应表明固定化酶与底物亲和力增强,有利于酶促反应。
纤维素不易被微生物分解,且含有大量羟基,羟基能通过化学反应带有多种活泼的官能团,而与酶上的官能团发生共价反应固定化酶。于殿宇等[11]以高碘酸钠活化的纤维素滤纸膜固定化磷脂酶 A1。与游离磷脂酶 A1 相比,固定化磷脂酶 A1 的 pH 耐受性和温度稳定性增强。重复使用 7 次后,固定化磷脂酶 A1 催化活性仍有初始活性的 65% 以上。 Fbd 等[12]以三醋酸纤维素作为载体固定化磷脂酶,三醋酸纤维素比普通的纤维素更疏水,在脂肪酶固定化中表现出良好的性能,是固定化磷脂酶的良好候选载体材料。磷脂酶 A1 在三醋酸纤维素中的固定化率在 60 min 内达到 97. 1% ,酶活为 975. 8 U /g。固定化后的磷脂酶 A1 具有良好的热稳定性和 pH 稳定性。
天然高分子材料安全无毒,符合绿色生产的要求,与酶结合能力良好,固定化条件温和,操作简易,具有广阔的应用前景。天然高分子材料固定化磷脂酶已被成功应用于生产实践中,如陈丽萍等[13]将海藻酸钠固定的磷脂酶 A1 应用于大豆油脱胶,脱胶后测得大豆油中磷含量为 9. 87 mg / kg,符合油脂中低磷含量要求。
2. 2 合成高分子材料
合成高分子材料具备机械强度高、物理化学性质确定等优点而受到研究者们的喜爱。应用于磷脂酶固定化的合成高分子材料主要为合成树脂类,合成树脂大多通过简单的吸附作用与磷脂酶结合,对酶结构的破坏较小。
Liu 等[14]以阴离子交换树脂 D202 固定化磷脂酶 A1,酶活达到 1 682 U /g,酶活残留率为 33. 0% 。利用固定化酶催化大豆油甘油解生产功能性食用油甘油二酯( DAG) ,在 45 ℃ 反应 12 h,DAG 产量为 53. 9% ,与游离酶( 54. 7% ) 接近。固定化酶连续使用 28 批次后,DAG 产量为 31. 8% ,而游离酶在连续使用 10 次 后,DAG 产 量 仅 21. 9% 。Li 等[15] 以 D380 树脂对磷脂酶 A1 进行固定,得到的固定化酶活力为 720. 95 U /g。利用酯交换反应体系催化合成 DHA /EPA 型磷脂,固定化磷脂酶 A1 的催化效果远高于游离磷脂酶 A1。反应 24 h 后,以固定化磷脂酶 A1 作为催化剂,DHA /EPA 总结合率为 19. 5% ,然而以游离磷脂酶 A1 作为催化剂,DHA /EPA 的总结合率仅为 7. 4% 。固定化酶重复使用 6 次后,残存的酶活力仍可达到 48. 9% 。聚苯乙烯二乙烯苯树脂[16]和 D001 树脂[17]也被用于磷脂酶的固定化研究。
以上结果表明,合成树脂固定化磷脂酶催化活性优良,将其应用于生产实践中,产品产量及固定化磷脂酶重复使用性均优于游离酶。此外,合成树脂固定化磷脂酶还被用于大豆油脱胶[18]、催化制备果糖月 桂 酸 单 酯[19]、DHA 型 磷 脂[20]、磷 脂 酰 丝 氨酸[21]、富含共轭亚油酸磷脂[22]等中。
3 复合载体材料
复合材料是一种混合物,由两种或两种以上材料通过物理或者化学手段组合而成。复合材料的性能不单是简单地单一材料性能的相加,还可能通过复合效应产生原材料不具备的新性能。常见的固定化磷脂酶复合材料包括天然高分子复合材料、合成 - 天然高分子复 合 材 料 以 及 无 机 - 有 机 复 合材料。
3. 1 天然高分子复合材料
将天然高分子材料如海藻酸钠、壳聚糖和明胶组合是常见的固定化磷脂酶材料,如海藻酸钠和壳聚糖复合物固定化磷脂酶 A1 [23]、磷脂酶 A2 [24],海藻酸钠和明胶复合物固定化磷脂酶 A1 [25],最大酶活回收率均大于 60% ,重复使用性优良。与游离磷脂酶相比,固定化后磷脂酶的热、pH 稳定性均得到提高。张智等[26]分别采用海藻酸钠、海藻酸钠 - 壳聚糖和海藻酸钠 - 明胶为载体固定化磷脂酶 A1。重复使用 4 次后,两种复合材料固定化磷脂酶 A1 的相对酶活仍保留在 80% 左右,而以单一材料为载体固定化磷脂酶 A1 的相对酶活仅剩 50% 。研究表明,复合材料固定化磷脂酶的操作稳定性高于单一材料固定化磷脂酶。
复合天然高分子材料提高了酶的稳定性和重复使用率,扩大了固定化磷脂酶的应用范围。目前,复合天然高分子材料固定化磷脂酶主要用于油脂脱胶,如海藻酸钠和壳聚糖的复合材料固定化磷脂酶用于大豆油脱胶[27]和菜籽油脱胶[28],海藻酸钠和明胶的复合材料固定化磷脂酶用于冷榨菜籽油脱胶[29],脱胶效果均较好。
3. 2 合成 - 天然高分子复合材料
合成 - 天然高分子复合材料固定化磷脂酶,兼具合成高分子材料和天然高分子材料的优点。时敏等[30]将纤维素衍生物醋酸纤维素制成铸膜液,涂在聚四氟乙烯基膜表面,得到复合膜固定化磷脂酶 A1。聚四氟乙烯基膜为多孔状结构,有利于酶分子的附着,醋酸纤维素提供活性基团。固定化磷脂酶 A1 的最大酶活力为 4. 0 U /cm2 。Zhan 等[31]将一定量的磷脂酶 A1 溶液加入充分溶解的海藻酸钠和聚乙烯醇溶液中,然后注入硼酸和氯化钙混合溶液中,浸泡若干分钟,形成微球。聚乙烯醇提高了微球的机械强度,海藻酸钠形成多孔结构有利于磷脂酶 A1 进入且能抑制微球聚集在一起。固定化磷脂酶 A1 最高 酶 活 达 到 126. 50 U /g,固定化效率达到 85. 32% 。重复使用 8 次后,固定化磷脂酶 A1 仍然保留了 50. 37% 的初始酶活。在 4 ℃储存 6 周后,固定化磷脂酶 A1 酶活为初始酶活的 78. 58% 。
固定化酶的催化活性、重复使用性和操作稳定性都较好,且结合了两种材料的优点,但目前对于合成 - 天然高分子材料固定化磷脂酶的研究较少。
3. 3 无机 - 有机复合载体材料
无机 - 有机复合材料固定化磷脂酶,多采用有机高分子材料包裹无机纳米粒子形成纳米复合微球固定化磷脂酶。梁江[32]以壳聚糖包裹纳米二氧化硅为载体固定化磷脂酶 D,纳米二氧化硅提供核,壳聚糖提供大量活性基团。固定化酶催化效率是游离酶的 1. 16 倍,pH 耐受性变宽; 重复使用 7 次后,仍有 60%的残余酶活; 保存 70 d 后,酶活剩余 50%。
复合纳米微球催化活性、操作和储藏稳定性均良好,但复合纳米微球从反应体系中分离回收困难,易造成损失[33]。磁性纳米微球由磁性纳米粒子与有机材料复合而成。磁性纳米粒子表面可通过包裹或接枝作用结合含多种功能基团的有机材料。通过外部磁铁作用,固定化酶与反应体系能快速分离; 撤除外部磁铁,固定化酶能稳定悬浮在反应体系中。因此,磁性纳米微球是良好的固定化酶材料[34]。
Yu 等[35]使用 Fe3O4 / SiOx - g - P( GMA) 磁性纳米微球固定化磷脂酶 A1,扫描电子显微镜结果表明形成的纳米微球直径约为 250 nm。在最优条件下,固定化效率为64. 7% ,酶活为2 066. 67 U /g。与游离磷脂酶 A1 相比,固定化磷脂酶 A1 的 pH 和温度稳定性更好。将固定化酶用于大豆油脱胶,脱胶 7 h 后,脱胶油中磷含量为 9. 6 mg / kg,低于传统的水化脱胶( < 10 mg / kg) 。55 ℃ 脱胶 10 次后,残余酶活为初始酶活的 80% 以上。Qu 等[36]使用该载体固定化磷脂酶 A2,得到的酶固载率及催化活性最大,分别为 122. 60 mg /g 和 1 289 U /g,用于大豆油脱胶,脱胶油磷含量为 9. 8 mg / kg,使用 5 次后,酶活损失较小。目前,磁性纳米微球越来越受到国内外研究者的重视,如固定化碱性蛋白酶[37]、脂肪酶[38 - 39],但将磷脂酶固定在磁性纳米粒子上的研究并不多见。
4 无载体———交联酶聚集体( CLEAs)
CLEAs 不需要载体,操作简单,酶活性中心未被破坏,酶活回收率极高,极 具 开 发 价 值[40]。鱼园[41] 以磷 脂 酶 D 制 备 CLEAs,最大催化活性为 15. 62 U /mg,酶活回收率为 86% ,重复使用 10 个批次后,酶活为初始酶活的 55% 。然而,无载体固定化酶难以回收、机械强度差,因此人们考虑对 CLEAs 进行改进。王妍等[42]将磷脂酶 A1 制备成 CLEAs,然后使用海藻酸钙凝胶进行包埋,增强了机械强度,克服了其不易回收的缺陷。固定化酶的耐热性高于游离酶,且更耐碱; 重复使用 6 个批次后,固定化酶酶活仍保持 65% 以上。
5 结束语
对磷脂酶固定化载体材料的研究从未停止,由早期的单一材料发展到复合材料,由直接使用自然界的已有材料到对已有材料进行改性和使用新型材料,有效提高了磷脂酶的稳定性和催化活性,扩大了磷脂酶的应用范围。对磷脂酶固定化载体材料的选择,需要综合考虑多方面因素,包括载体材料的来源、理化性质、应用环境等,优良的载体材料需要与酶及应用相匹配。随着化工、材料和生物技术的发展,根据磷脂酶特性和固定化需要设计制备性能优良的载体将成为磷脂酶固定化材料的重要选择方向,这需要研究者们更深入掌握磷脂酶的物化特性和应用环境。
参考文献:
[1]KATCHALSKI - KATZIR E. Immobilized enzymes—learning from past successes and failures[J]. Trends Biotechnol,1993,11( 11) : 471 - 478.
[2]YU D,MA Y,JIANG L,et al. Stability of soybean oil degumming using immobilized phospholipase A2[J]. J Oleo Sci,2014,63( 1) : 25 - 30.
[3]曹林秋. 载体固定化酶: 原理、应用和设计[M]. 北京: 化学工业出版社,2008.
[4]陶明,张丽霞,单良. 有机改性凹凸棒土交联吸附法固定化磷脂酶 A1 研究[J]. 粮食与油脂,2009( 11) : 12 - 15.
[5]LI Z,LIU H,ZHAO G,et al. Enhancing the performance of a phospholipase A1,for oil degumming by bio - imprinting and immobilization[J]. J Mol Catal B Enzym,2016, 123: 122 - 131.
[6]CAO S,XU P,MA Y,et al. Recent advances in immobilized enzymes on nanocarriers[J]. Chin J Catal,2016,37 ( 11) : 1814 - 1823.
[7]LI B,WANG J,ZHANG X,et al. An enzyme net coating the surface of nanoparticles: a simple and efficient method for the immobilization of phospholipase D[J]. Ind Eng Chem Res,2016,55( 40) : 10555 - 10565.
[8]周荧,魏建林,罗胜保,等. 响应曲面法优化介孔分子筛固定化 β - 葡萄糖苷酶的工艺研究[J]. 粮食科技与经济,2016,41( 3) : 35 - 40.
[9]XUE P,LU G,GUO Y,et al. A novel support of MCM - 48 molecular sieve for immobilization of penicillin G acylase [J]. J Mol Catal B Enzym,2004,30( 2) : 75 - 81.
[10]孙万成,蒋笃孝,宋龄瑛,等. 壳聚糖/海藻酸钠微胶囊固定化磷脂酶 A1 ( PLA1 ) 的研 究[J]. 食 品 科 技, 2004( 11) : 14 - 17.
[11]于殿宇,马莺,刘晶,等. 高碘酸钠氧化法固定化磷脂酶 A1 的研究[J]. 食品工业科技,2012,33( 7) : 188 - 190.
[12]FBD S,MORAIS J NIOR W G,CVD S,et al. Preparation and characterization of cellulose triacetate as support for Lecitase Ultra immobilization[J]. Molecules,2017, 22( 11) : 1930.
[13]陈丽萍,宋鹏,解桂东,等. 海藻酸钠固定化磷脂酶用于大豆油脱胶[J]. 农业机械,2013( 17) : 53 - 56.
[14] LIU N,WANG Y,ZHAO Q,et al. Immobilisation of Lecitase Ultra for production of diacylglycerols by glycerolysis of soybean oil[J]. Food Chem,2012,134( 1) : 301 - 307.
[15]LI X,CHEN J F,YANG B,et al. Production of struc- tured phosphatidylcholine with high content of DHA/EPA by immobilized phospholipase A1 - catalyzed transesterification[J]. Int J Mol Sci,2014,15( 9) : 15244 - 15258.
[16]ALVES J S,GARCIA - GALAN C,DANELLI D,et al. Use of Lecitase Ultra immobilized on styrene - divinylbenzene beads as catalyst of esterification reactions: effects of ultrasounds[J]. Catal Today,2015,255: 27 - 32.
[17]水龙龙,操丽丽,庞敏,等. 大孔树脂固定化磷脂酶 A1 及其用于菜籽油脱胶工艺的优化[J]. 食品科学, 2018,39( 4) : 241 - 247.
[18]李春,戴大章,梁美丽,等. 一种固定化重组磷脂酶 B 用于植物油脂脱胶的方法: CN103849461A[P]. 2014 - 06 - 11.
[19]付敏,赵谋明,刘宁,等. 固定化磷脂酶 Lecitase Ultra 催化合成果糖月桂酸单酯的研究[J]. 现代食品科技,2012,28( 9) : 1153 - 1156.
[20]马彦庆,陈斌斌,郑妍,等. 固定化磷脂酶 A1 催化制备 DHA 型磷脂[J]. 中国粮油学报,2015,30 ( 3) : 75 - 79.
[21]刘倩倩,邱永乾,刘炯钦,等. 大孔树脂固定化磷脂酶 D[J]. 工业微生物,2016,46( 3) : 25 - 30.
[22]朱珊珊,李铁,王永华,等. 磷脂酶 A1 的固定化及应用研究[J]. 中国油脂,2010,35( 12) : 33 - 37.
[23]孙万成,蒋笃孝,罗毅皓. 壳聚糖/海藻酸钠微胶囊固定化磷脂酶 A1 及其结构考察[J]. 食品科学,2005, 26( 9) : 100 - 103.
[24]张佳宁,宋云花,王玥,等. 海藻酸钠 - 壳聚糖固定化磷脂酶 A2 的研究[J]. 食品工业科技,2012,33( 21) : 201 - 205,209.
[25]于殿宇,罗淑年,王瑾,等. 海藻酸钠 - 明胶固定化磷脂酶的研究[J]. 食品工业,2008( 3) : 9 - 11.
[26]张智,王瑾,王腾宇,等. 磷脂酶固定化方法的研究[J]. 中国油脂,2009,34( 9) : 35 - 38.
[27]卞清德,马英昌,罗淑年,等. 固定化磷脂酶用于大豆油脱胶的研究[J]. 中国油脂,2009,34( 7) : 1 - 4.
[28]王瑾,王世让,杨帆,等. 固定化磷脂酶用于菜籽油脱胶[J]. 粮油加工,2009( 7) : 53 - 56.
[29]王瑾,李振岚,王玉,等. 固定化磷脂酶用于冷榨菜籽油脱胶[J]. 食品工业科技,2010,31( 9) : 276 - 278.
[30]时敏,周晓丹,李越,等. 醋酸纤维素/聚四氟乙烯复合膜固定化磷脂酶 A1 的研究[J]. 食品工业科技, 2012,33( 13) : 127 - 130,134.
[31] ZHAN J F,JIANG S T,PAN L J. Immobilization of phospholipase A1 using a polyvinyl alcohol - alginate matrix and evaluation of the effects of immobilization[J]. Braz J Chem Eng,2013,30( 4) : 721 - 728.
[32]梁江. SiO2 - CS 纳米复合载体固定化磷脂酶 D 的研究[D]. 西安: 西北大学,2014.
[33]CABRERAPADILLA R Y,LISBOA M C,FRICKS A T, et al. Immobilization of Candida Rugosa lipase on poly ( 3 - hydroxybutyrate - co - hydroxyvalerate) : a new eco - friendly support[J]. J Ind Microbiol Biotechnol,2012, 39( 2) : 289 - 298.
[34]LAKOURAJ M M,MAASHSANI A,NOROUZIAN R S, et al. Immobilization of pepsin on chitosan magnetic nanoparticles and its application in deacetylation of amides [J]. J Carbohydr Chem,2015,34( 2) : 103 - 119.
[35]YU D,MA Y,XUE S J,et al. Characterization of immobilized phospholipase A1 on magnetic nanoparticles for oil degumming application[J]. LWT - Food Sci Technol, 2013,50( 2) : 519 - 525.
[36] QU Y,SUN L,LI X,et al. Enzymatic degumming of soybean oil with magnetic immobilized phospholipase A2 [J]. LWT - Food Sci Technol,2016,73: 290 - 295.
[37]李杨,江连洲,李丹丹,等. 氨基硅烷修饰的磁性纳米粒子固定化碱性蛋白酶[J]. 食品科学,2012,33( 9) : 202 - 205.
[38] KARIMI M. Immobilization of lipase onto mesoporous magnetic nanoparticles for enzymatic synthesis of biodiesel [J]. Biocatal Agric Biotechnol,2016,8( 1) : 182 - 188.
[39] MOTEVALIZADEH S F,KHOOBI M,SADIGHI A,et al. Lipase immobilization onto polyethylenimine coated magnetic nanoparticles assisted by divalent metal chelated ions[J]. J Mol Catal B Enzym,2015,120: 75 - 83.
[40]王梦凡,齐崴,苏荣欣,等. 交联酶聚体技术研究进展[J]. 化学进展,2010,22( 1) : 173 - 178.[41]鱼园. 载体吸附交联及无载体交联固定化磷脂酶 D 方法的研究[D]. 西安: 西北大学,2010.
[42]王妍,王雪,李越,等. 包埋 - 交联磷脂酶 A1 聚集体的制备及酶学性质[J]. 食品科学,2012,33( 5) : 118 - 123.
推荐阅读:工业废水检测在化学技术上有何提升
- 评职发表一篇职称论文要
- 高校教师职称评审权下放
- 评职称的专著需要鉴定吗
职称问题解析
- 简述建筑设计师任职要求
- 林业类职称成果有什么要
- 强度与环境期刊投稿要求












