活化α7烟碱型乙酰胆碱受体对呼吸机与大鼠的保护机制研究
【摘要】 目的 评价激活 α7 烟碱型乙酰胆碱受体对大鼠呼吸机相关肺损伤的影响。 方法采用随机数字法将 32 只雄性 Sprague Dawley 大鼠分为:对照组(C 组)、机械通气组(V 组)、烟碱预处理 + 机械通气组(N 组)、甲基牛扁碱(MLA)+ 烟碱 + 机械通气组(MLA 组),每组 8 只。C 组大鼠气管插管后不进行机械通气,保留自主呼吸,其余各组大鼠机械通气 2 h。N 组大鼠在机械通气前 30 min 腹腔注射 1 mg / kg 的烟碱;MLA 组大鼠在腹腔注射烟碱前 30 min 先腹腔注射 1 mg / kg 的 MLA,其余各组大鼠腹腔注射等量等渗 NaCl 溶液。机械通气结束后即刻处死大鼠,计算各组大鼠肺组织湿重 / 干重、苏木素-伊红(HE)染色、肺组织损伤病理学评分,并采用 Western-blotting 检测白细胞介素 1β(IL-1β)、IL-6、肿瘤坏死因子 α(TNF-α)蛋白表达水平。 结果 C 组大鼠肺泡形态结构正常;V 组大鼠肺泡形态结构破坏,大量炎症细胞浸润;N 组大鼠肺泡形态结构稍破坏,少量炎症细胞浸润;MLA 组大鼠肺泡形态结构破坏,肺泡萎陷,较多炎症细胞浸润。4 组大鼠肺组织湿重 / 干重、损伤评分、IL-1β、IL-6 及 TNF-α 蛋白表达水平比较,差异均有统计学意义 (F = 168.009、647.579、138.005、192.706、178.094,P 均 < 0.05)。进一步两两比较发现,V 组大鼠肺组织湿重 / 干重、损伤评分、IL-1β、IL-6、TNF-α 蛋白表达水平均较 C 组更高(P 均 < 0.05);N 组大鼠湿重 / 干重、损伤评分、IL-1β、IL-6、TNF-α 蛋白表达水平均较 V 组明显降低(P 均 < 0.05);MLA 组大鼠肺组织湿重 / 干重、损伤评分、IL-1β、IL-6、TNF-α 蛋白表达水平均较 N 组明显升高,差异有统计学意义(P 均 < 0.05)。 结论 烟碱对呼吸机相关肺损伤的大鼠模型具有保护作用,其机制与激活 α7-nAChR 有关。
【关键词】 呼吸机相关肺损伤;α7-nAChR;大鼠
机械通气是急性肺损伤和急性呼吸窘迫征的重要治疗手段,尽管采用了小潮气量的通气策略,仍会引起部分肺泡组织的过度扩张,导致呼吸机相关性肺损伤(ventilator-induced lung injury,VILI)[1-2]。VILI 的特点是肺泡上皮细胞和内皮细胞的通透性增加,以及肺组织的炎症反应。研究表明,VILI 大鼠模型过量表达核因子 κB、白细胞介素 6(interleukin-6, IL-6)、IL-1β 等,这些炎症细胞因子可进一步引起全身多器官功能障碍 [3-4]。α7 烟碱型乙酰胆碱受体(alpha7 nicotinic acetylcholine receptors,α7- nAChR)表达于巨噬细胞及上皮细胞,迷走神经分泌乙酰胆碱激活 α7-nAChR,来调节炎症细胞因子的合成与分泌。迷走神经分泌乙酰胆碱来调节机体炎症反应已经在脓毒血症大鼠模型中被证实[5]。甲基牛扁碱(methyllycaconitine,MLA)是 α7-nAChR 特异性的阻断剂,本研究中拟用 MLA 阻断 α7-nAChR 来探讨 α7-nAChR 在 VILI 大鼠模型中的作用,为临床研究提供参考。
1 材料与方法
1.1 实验动物及试剂
选取 32 只健康清洁的雄性 Sprague Dawley 大鼠(8 ~ 12 周龄,体质量 200 ~ 220 g),购于南京大学模式动物研究所,饲养于扬州大学动物实验中心,以常规饲料喂养,实行 12 h 昼夜循环。运用随机数字分配的方法将 32 只实验大鼠分为:对照组(C 组)、机械通气组(V 组)、烟碱 + 机械通气组(N 组)、 MLA + 烟碱 + 机械通气组(MLA 组),每组 8 只。
各组大鼠机械通气前均禁食、禁水 12 h,腹腔注射 2%戊巴比妥钠(20 mg / kg)进行麻醉,麻醉后备皮消毒,将 16 G 静脉穿刺针插入大鼠气管内作为气管导管,接动物呼吸机(购于南京大学动物实验仪器厂)进 行 机 械 通 气 ,通 气 参 数 为 :潮 气 量 8 ~ 10 mL / kg、通气频率 35 次 / min、吸呼比为 1 ∶ 1[6]。C 组大鼠气管插管后不进行机械通气,保留自主呼吸,其余各组大鼠机械通气 2 h;烟碱及 MLA 均溶于 4 mL 等渗 NaCl 溶液中,N 组大鼠在机械通气前 30 min 腹腔注射烟碱(1 mg / kg);MLA 组大鼠在腹腔注射烟碱前 30 min 先腹腔注射 MLA(1 mg / kg); C 组、V 组大鼠在造模前均腹腔注射等渗 NaCl 溶液 4 mL。烟碱、MLA 均购买于 Sigma 公司。本研究经医院伦理委员会审核通过。
1.2 肺组织湿重 / 干重
各组大鼠通气 2 h 后用颈椎脱臼法处死,取右上肺组织称重(湿重),然后置于 85 ℃烤箱中 72 h,称重(干重),计算肺组织湿重 / 干重[7-8]。
1.3 肺组织苏木素-伊红(hematoxylin-eosin,HE)染色与损伤评分
取各组大鼠右中肺组织,在 4%多聚甲醛中浸泡 24 h 后用石蜡包埋,制备 5 μm 厚的切片,进行常规 HE 染色。光镜下观察肺组织形态学改变并进行肺损伤评分,包括肺泡水肿、肺间质水肿、肺泡内充血和中性粒细胞浸润(无改变或非常轻微为 0 分;轻度改变为 1 分;中度改变为 2 分;重度改变为 3 分;极重度改变为 4 分)[9]。
1.4 Western-blotting 检测各组大鼠肺组织 IL- 1β、IL-6 及 肿 瘤 坏 死 因 子 α (tumor necrosis factor-alpha,TNF-α)蛋白表达水平
取各组大鼠右下肺组织,按常规方法加入裂解液 400 μL [50 mM NaCl,10 mM Tris,1 mM 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA), 1 mM 苯 甲 基 磺 酰 氟 化 物 (phenylmethyl sulfonylfluoride,PMSF),0.5 mM 钒酸钠,50 mM 氟化钠,1 mM 苯甲脒,1 mg / L 抑肽酶]反复研磨。30 min 后,将裂解液移至 1.5 mL 离心管中,然后在离心器下以 12 000 r / min 离心 5 min,离心半径 5 cm,取上层清液。通过二喹啉甲酸(bicinchoninic acid,BCA)蛋白分析装置测定各样品蛋白浓度,用磷酸缓冲盐溶液(phosphate buffer saline,PBS) 配平并煮沸蛋白。制备十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶,每孔蛋白上样量 30 μg 后电泳,再用电转移法将蛋白质从 SDS-PAGE 凝胶转移至硝酸纤维素(nitrocellulose,NC)膜上,室温下用 5%的脱脂奶粉封闭 1 h,分别加入抗鼠 IL- 1β(1 ∶ 1 000),IL-6(1 ∶ 1 000),TNF-α(1 ∶ 500)单克隆抗体,再加入抗兔二抗,孵育洗涤后采用增强化学发光法检测这些蛋白,并用凝胶成像分析系统进行扫描分析[10]。
1.5 统计学方法
应用 SPSS 18.0 统计软件进行统计学分析,计量资料用均数 ± 标准差(x軃 ± s)表示,各组大鼠肺组织湿重 / 干重、损伤评分以及 IL-1β、IL-6 和 TNF-α 蛋白表达水平比较采用单因素方差分析,进一步两两比较采用 LSD 检验,以 P < 0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠肺组织 HE 染色结果
C 组大鼠见肺泡形态和肺泡间隔距离正常,肺泡腔内无渗出、出血,未见明显炎症细胞浸润;V 组大鼠见肺泡结构明显破坏,肺泡萎陷,肺泡内大量渗出,透明膜形成,肺泡内及肺泡间质大量炎症细胞浸润;N 组大鼠肺泡形态稍破坏,肺泡间隔基本正常,肺泡内少量渗出及出血,少量炎症细胞浸润;MLA 组见明显肺泡结构破坏,肺泡间隔增大,较多肺泡萎陷,肺泡内及肺间质炎症细胞较多,见图 1。
2.2 各组大鼠肺组织湿重 / 干重及损伤评分
4 组大鼠肺组织湿重 / 干重及损伤评分比较,差异均有统计学意义 (F = 168.009、647.579,P = 0.001、< 0.001)。进一步两两比较发现,V 组大鼠肺组织湿重 / 干重及肺组织损伤评分均较 C 组明显升高(P 均 < 0.05);N 组大鼠肺组织湿重 / 干重及肺组织损伤评分均较 V 组明显降低(P 均 < 0.05);MLA 组大鼠肺组织湿重 / 干重及肺组织损伤评分均较 N 组明显升高(P 均 < 0.05),见表 1。
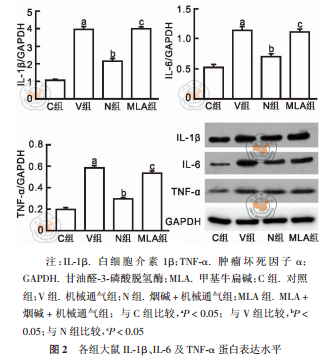
2.3 各组大鼠 IL-1β、IL-6 及 TNF-α 蛋 白 表达水平
4 组大鼠肺组织 IL-1β、IL-6、TNF-α 蛋白表达水平 比 较 , 差 异 均 有 统 计 学 意 义 (F = 138.005、 192.706、178.094,P = 0.012、< 0.001、0.001)。进一步两两比较发现,V 组大鼠肺组织 IL-1β、IL-6、TNF-α 蛋白表达水平均较 C 组更高(P 均 < 0.05);N 组大鼠 IL-1β、IL-6、TNF-α 蛋白表达水平均较 V 组明显降低(P 均 < 0.05);MLA 组大鼠肺组织 IL-1β、IL-6、 TNF-α 蛋白表达水平均较 N 组明显升高,差异有统计学意义(P 均 < 0.05),见图 2。
3 讨论
本研究通过测定各组大鼠肺组织湿重 / 干重、 HE 染色及肺组织损伤评分发现,V 组大鼠肺组织湿重 / 干重较 C 组更高,肺间质广泛水肿,肺泡腔出血,肺泡萎陷,肺组织被大量炎症细胞浸润,损伤更加严重,进一步提示 Sprague-Dawley 大鼠给予 8 ~ 10 mL / kg 的潮气量可以用来构建 VILI 的动物模型进行相关研究;N 组大鼠肺组织湿重 / 干重较 V 组明显减少,肺组织病理损伤明显减轻,因此烟碱对 VILI 的大鼠模型具有保护作用;V 组与 MLA 组相比,我们还发现如果阻断了 α7-nAChR,烟碱的这种保护作用将消失,提示烟碱对 VILI 大鼠模型的保护作用与激活 α7-nAChR 相关。
机械通气可以引起广泛的生物学应答,包括激活促炎细胞因子和细胞因子的级联放大系统[11-12]。而且这些肺组织产生的促炎细胞因子和炎症调节因子通过循环系统到达人体各个器官,引起多器官功能障碍[13]。Yang 等[14]在机械通气的 Wistar 大鼠模型中发现,机械通气后,大鼠肺组织中 IL-1β、TNF-α 含量明显增加。Ma 等[1]研究发现,给予 Sprague-Dawley 大鼠 7 mL / kg 的潮气量后,大鼠肺组织中 IL-1β、IL-6 和 TNF-α 过量表达。本研究与上述研究结果相一致。肺泡巨噬细胞在 VILI 中起关键作用,活化的巨噬细胞可以产生 IL-1β、IL-6、TNF-α 等炎症细胞因子,引起肺损伤[15-17]。
α7-nAChR 主要表达于巨噬细胞和上皮细胞,烟碱结合并激活 α7-nAChR 可以抑制巨噬细胞产生和释放 IL-1β、IL-6、TNF-α 等炎症细胞因子。相反的,Wang 等[18]在 α7-nAChR 缺乏的野生小鼠模型中发现,电刺激迷走神经不能抑制 TNF 的合成,因此 α7-nAChR 在调节机体炎症反应过程中起关键作用。Ma 等[19]在胰腺炎相关肺损伤的大鼠模型中证实,尼古丁激活 α7-nAChR 后,不仅能减轻胰腺组织的水肿坏死,也能显著减轻肺组织的病理损伤,大鼠血清中 IL-6、髓过氧化物酶、TNF-α 等炎症因子也明显减少。He 等[20]在肠缺血再灌注肺损伤的 SpragueDawley 大鼠模型中发现,激活 α7-nAChR 可以通过抑制 Toll 样受体 4 / 核因子 κB 信号通路减轻肠缺血再灌注导致的肺组织氧化应激以及炎症反应。但是 α7-nAChR 在 VILI 中的作用仍有待研究。
本研究证实,激活 α7-nAChR 在 VILI 大鼠模型中起保护作用,可以减轻肺组织的病理损伤,并抑制 IL-1β、IL-6、TNF-α 炎症细胞因子的表达。但是激活 α7-nAChR 通过何种分子信号机制来抑制炎症细胞因子的表达,仍需进一步研究。
参 考 文 献
1 Ma H, Feng X, Ding S. Hesperetin attenuates ventilator-induced acute lung injury through inhibition of NF-κB-mediated inflammation [J]. Eur J Pharmacol, 2015 (769): 333-341.
2 Vasques F, Duscio E, Cipulli F, et al. Determinants and prevention of ventilator-induced lung injury[J]. Crit Care Clin, 2018, 34 (3): 343-356.
3 Ding N, Wang F, Xiao H, et al. Mechanical ventilation enhances HMGB1 expression in an LPS-induced lung injury model[J]. PLoS One, 2013, 8 (9): e74633.
4 Gao W, Ju YN. Budesonide attenuates ventilator-induced lung injury in a rat model of inflammatory acute respiratory distress syndrome[J]. Arch Med Res, 2016, 47 (4): 275-284.
5 Pavlov VA, Ochani M, Gallowitsch-Puerta M, et al. Central muscarinic cholinergic regulation of the systemicinflammatory response during endotoxemia[J]. Proc Natl Acad Sci USA, 2006, 103 (13): 5219-5223.
6 Kox M, Pompe J, Vaneker M, et al. The selective α7 nicotinic acetylcholine receptor agonist GTS-21 attenuates ventilator-induced inflammation and lung injury[J]. Crit Care, 2009, 13 (S1): P55.
7 高巨,张扬,方向志. 机械通气预处理对大鼠机械通气相关性肺损伤的影响 [J]. 中华麻醉学杂志,2014,34(12): 1430-1432.
8 杨茂宪,施云超,朱建刚,等. 俯卧位通气对肺内源性急性肺损伤大鼠的影响[J/CD]. 中华危重症医学杂志(电子版),2016,
9(1):9-13. 9 Kozian A, Schilling T, Fredén F, et al. One-lung ventilation induces hyperperfusion and alveolar damage in the ventilated lung: an experimental study [J]. Br J Anaesth, 2008, 100 (4): 549-559.
10 朱庆程,胡军,范卫民. 2 型糖尿病对骨代谢的影响及机制[J]. 江苏医药,2016,42(5):497-499.
11 Cressoni M, Gotti M, Chiurazzi C, et al. Mechanical power and development of ventilator-induced lung injury [J]. Anesthesiology, 2016, 124 (5): 1100-1108.
12 么颖,余慕明,刘艳存,等. 持续监测和控制人工气道气囊压力对机械通气患者呼吸机相关肺炎发生率影响的 Meta 分析 [J/CD]. 中华危重症医学杂志 (电子版), 2016,9(6):389-393.
13 Dolinay T, Kim YS, Howrylak J, et al. Inflammasomeregulated cytokines are critical mediators of acute lung injury[J]. Am J Respir Crit Care Med, 2012, 185 (11): 1225-1234.
14 Yang SH, Lin JC, Wu SY, et al. Membrane translocation of IL-33 receptor in ventilator induced lung injury[J]. PLoS One, 2015, 10 (3): e0121391.
15 Silva PL, Negrini D, Rocco PR. Mechanisms of ventilator-induced lung injury in healthy lungs [J]. Best Pract Res Clin Anaesthesiol, 2015, 29 (3): 301-313.
16 张慧慧,蔡国龙,胡才宝,等. 乌司他丁对脓毒症大鼠急性肺损伤的保护作用及其机制研究 [J/CD]. 中华危重症医学杂志(电子版),2017,10(3):153-158.
17 李慢中,王雅丽,李朝霞,等.蛭丹化瘀组方对 LPS 诱导急性肺损伤大鼠炎性反应的影响[J].世界中医药,2016,11 (5):876-879.
18 Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor α7 subunit is an essential regulator of inflammation[J]. Nature, 2003, 421 (6921): 384-388.
19 Ma P, Yu K, Yu J, et al. Effects of nicotine and vagus nerve in severe acute pancreatitis-associated lung injury in rats[J]. Pancreas, 2016, 45 (4): 552-560.
20 He Y, Ye ZQ, Li X, et al. Alpha7 nicotinic acetylcholine receptor activation attenuated intestine-derived acute lung injury[J]. J Surg Res, 2016, 201 (2): 258- 265.
相关论文推荐:化学类专业创新实验教学的探索与思考
《活化α7烟碱型乙酰胆碱受体对呼吸机与大鼠的保护机制研究》
- 花卉园艺论文盆栽花卉养
- 科技改革论文简析邓小平
- 新闻论文发表媒介终端化
- 内蒙煤炭论文发表分析煤
- 电气自动化技术新发展运
- 中国外语教学期刊征稿目
- 液压与气动杂志2016年目录
- 中级科技职称论文范文:
最新优质论文
- 评价期刊质量的指标
- 写车床维修论文参考哪些
- 中国民族博览是艺术类核
- 如何让sci杂志延长修稿时
- 施工技术期刊发论文要求
- cpci是什么领域论文数据库
- 两三千字论文能发核心吗
- 最新!锡林郭勒盟在全区
论文发表问题热点
- 金属成型方面评职称用论
- 发表论文有哪些不错的平
- 医学论文准备格式基本要
- 吉林职称发一篇论文多少
- 电气方面的职称都有哪些
- 景观设计行业的职称论文
- 包装设计类期刊哪些收录
- 医学学术杂志的常见鉴别












