糖鞘脂的生物学功能及相关药物开发研究
摘要:糖鞘脂是一类在细胞膜上成簇排列的两性分子,参与了细胞的黏附、生长、增殖、凋亡等。细胞发生癌变时,表面的某些糖鞘脂表达异常,通过检测特异性糖鞘脂的表达可以对某些癌症做出诊断。神经性疾病和遗传性疾病的产生或许与糖鞘脂的变化有着不可忽视的关系,某些糖脂已被公认为是干细胞的典型生物标志物。开发相应的糖鞘脂药物或抗体类药物,对于实现疾病的早期诊断和治疗等都具有重要意义。文章从糖鞘脂的结构与功能、糖鞘脂与神经性和遗传性疾病、糖鞘脂与干细胞、糖鞘脂与肿瘤以及鞘脂类药物开发等方面对近年来的研究进展作详细的总结。
关键词:糖鞘脂;肿瘤 ; 干细胞;生物标志物;药物开发
组成生命的基本物质包括四大类:4种核苷酸、20种基本氨基酸、8种脂肪酸和32种单糖。细胞中具有生物学功能的糖以糖链的形式存在,糖链与蛋白质或脂类相结合形成糖缀合物,包括糖脂(glycolipids)、糖蛋白(glycoproteins)、磷脂酰肌醇(glycosyl phosphatidyl inositol, GPI)锚定的蛋白和蛋白聚糖(proteoglycans)等。
在上述糖缀合物中,糖脂是糖类通过其还原末端与脂类以糖苷健的形式结合在一起形成的化合物的总称,其广泛分布于动物、植物和微生物等生物体中,是各种生物体细胞膜结构的重要组成部分。糖脂的种类繁多,不同类型的糖脂结构不同,其在生物体中的作用也有所不同,其中研究得较为深入和广泛的是糖鞘脂(glycosphingolipids)。近年来,随着生物化学和分子生物学等的发展,以及新型分离分析技术的涌现,对于糖鞘脂的结构、功能及应用的研究都取得了很大的进步[1]。本文将依次从糖鞘脂的结构与功能以及鞘脂类药物开发等方面对近年来的研究进展作详细的总结。
1 糖鞘脂的结构与功能
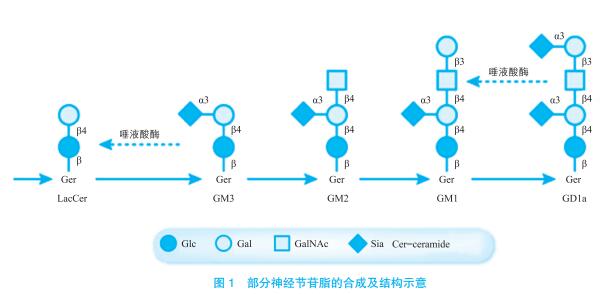
糖鞘脂是一类两性分子,由糖链、长链脂肪酸和鞘氨醇(sphingosine)的长链碱基三部分组成,疏水部分是鞘氨醇的氨基被脂肪酸酰化而成的脑酰胺(ceramide),而亲水部分的糖链与鞘氨醇的伯羟基相连。糖鞘脂在细胞膜上成簇排列,能够抵抗去垢剂的抽提[2]。根据核心结构的不同,糖鞘脂主要分为gala-、globo(Gb)-、isoglobo(iGb)-、 ganglio(Gg)-、lacto(Lc)-、neolacto(nLc)-、 arthro(Ar)-以 及mollu(MI)-等8类。 另 根 据 其携带唾液酸与否,糖鞘脂又可以分为中性糖鞘脂和酸性糖鞘脂。中性糖鞘脂是指不含唾液酸的糖鞘脂,酸性糖鞘脂是指含一个或者多个唾液酸的糖鞘脂,其中神经节苷脂(gangliosides)是酸性糖鞘脂中的重要成员(图1),主要存在于神经组织、脾脏与胸腺中。糖鞘脂的生物合成即通过在神经酰胺分子上顺序添加单糖而合成寡糖链,该过程主要是在真核细胞的内质网和高尔基体中进行,糖鞘脂的分解代谢主要发生在包涵体和溶酶体中。
糖鞘脂不仅是细胞结构的重要组成部分,而且参与了细胞的黏附、生长、分化、增殖、凋亡及信号转导等[3-5]。细胞发生癌变时,表面的某些糖鞘脂表达异常,通过检测特异性糖鞘脂的表达则可以对某些癌症做出诊断[6-8]。糖鞘脂与细胞上的一些功能蛋白如整合蛋白(integrin)、生长因子受体、四次跨膜蛋白,或非受体细胞质膜激酶(Src家族激酶,G- 蛋白等)相互作用,从而参与或介导了细胞黏附、生长和迁移。
2 鞘脂与神经性和遗传性疾病
神经性疾病,如帕金森综合征(Parkinson´s disease,PD)和阿尔茨海默病(Alzheimer disease, AD)的产生或许与糖鞘脂的变化有着不可忽视的关系。在小鼠中去除糖基转移酶相关基因,使小鼠的糖鞘脂不能正常代谢,小鼠会出现严重的神经性疾病,并很快死亡。糖鞘脂GM1在神经细胞的分化和发育中起重要作用,可以显著促进神经再生、促进神经轴突生长和突触形成、恢复神经支配功能。 PD发生的直接原因是多巴胺神经元大量死亡,临床使用糖鞘脂GM1可以改善PD病人的运动和认知功能障碍[9]。AD最主要的病理特征之一是老年斑(senile plaques,SP)形成。β-淀粉样蛋白(amyloid-β protein, Aβ)是 SP 的核心成分。AD 病人脑组织中的质膜 Aβ 可与 GM1 紧密结合产生GM1结合型Aβ (ganglioside-bound Aβ),膜结合型的GM1可以促进Aβ 的纤维化,说明GM1有可能参与AD的发病机制[10]。
细胞溶酶体中如果缺乏与糖鞘脂分解代谢的酶类,可以引起神经节苷脂在溶酶体中的堆积,从而引发Tay-sachs、Fabry和Gaucher等遗传性疾病。例如,机体内缺少α-半乳糖苷酶导致神经节苷脂尤其是Gb3的堆积,从而引起Fabry,临床上对血浆lysoGb3的测定可作为诊断Fabry的一种手段[11] ;β-葡萄糖苷脂酶(β-glucocerebrosidase)的缺损使葡萄糖神经酰胺过度表达,可引起Gaucher病[12]。此外,半乳糖脑苷脂酶的缺乏会引起Krabbe病,己糖胺酶缺乏可以造成Sandhoff 病 和Tay-sachs病[13]。可以看出,糖鞘脂代谢异常与遗传性疾病存在显著的因果关系,调节糖鞘脂的分解代谢水平有助于缓解或治疗上述遗传性疾病。
3 糖鞘脂与干细胞
干细胞是一类具有自我复制能力的多潜能细胞,在一定条件下,它可以分化成多种功能细胞。鉴于干细胞这种特性,可以将干细胞或相关衍生产品移植入患者体内,替换损伤细胞从而治愈疾病。由于在疾病治疗和再生医学领域的广阔应用前景,干细胞已成为21世纪初生命科学和医学研究的前沿和热点。根据干细胞所处的发育阶段分为胚胎干细胞和成体干细胞。根据干细胞的发育潜能分为三类 :全能干细胞、多能干细胞和单能干细胞。阶段特异性胚胎抗原-1(stage-specifi c embryonic antigen-1, SSEA-1)、SSEA-3、SSEA-4和GD3等几种糖脂结构在干细胞阶段呈特异性表达,已被公认为是干细胞的典型标志物。
SSEA-1是小鼠胚胎干细胞典型表面标志物,它的结构为Lewis X 抗原(Lex; Galβ1-4(Fucα1- 3)GlcNAcβ1-)[14]。根据细胞表面抗原分化命名原则,将SSEA-1 命名为CD15,它一般表达在蛋白聚糖、糖蛋白,以及neolacto-、lacto-、 ganglio-或者 globo-系列的糖鞘脂上。SSEA-1 在干细胞发生分化后表达显著下调,大约50%的胚胎干细胞表达SSEA-1,而分化后只有10%的细胞表达SSEA-1 [15]。有趣的是,人源胚胎干细胞不表达SSEA-1,但表达globo-系列的糖鞘脂SSEA-3 和SSEA-4,其结构为Galβ1-3GalNAcβ1-3Galα1- 4Galβ1-和 NeuAcα2-3Galβ1-3GalNAcβ1-结构(例如 Gb5Cer和 V3 NeuAcα-Gb5Cer)[16]。SSEA-3和 SSEA-4在人胚胎干细胞分化后同样表现出下降的趋势。同样地,鼠源的诱导性多能干细胞呈SSEA-1阳性,而人源诱导性多能干细胞呈SSEA-3和SSEA-4 阳性、SSEA-1阴性。
糖鞘脂GM1在神经干细胞和小鼠的造血干细胞的表达极为丰富,而且已确定糖鞘脂GD3在胚胎、出生后以及成体的小鼠神经干细胞中表达。已有足够的生化、免疫化学以及流式分析等证据证明 GD3是小鼠神经干细胞表达的主要糖鞘脂[17]。肿瘤干细胞,是指具有干细胞性质的癌细胞,也就是具有“自我复制”以及“多细胞分化”等能力。人源的乳腺肿瘤干细胞和非乳腺干细胞表达的globo-H (V2 Fucα-Gb5Cer)和SSEA-3具有明显差异[18],CD133 一般被认为是肿瘤干细胞的标志性抗原,而A2B5识别的抗原(其结构为c-系列神经节苷脂)在人脑肿瘤干细胞中表达比CD133更为丰富[19]。
4 糖鞘脂与肿瘤
肿瘤发生发展过程中,也伴随着糖鞘脂的表达异常。例如糖鞘脂GD3/GD2的合成酶基因ST8SIA1 在雌激素表达呈阴性的乳腺癌中高表达[20],导致了GD2表达呈显著升高[21]。 含N-乙酰神经氨酸的糖鞘脂GM3(NeuAcGM3)一般在正常的人体组织中表达,而很多肿瘤组织如非小细胞肺癌等表达高丰度的含N-羟乙酰神经氨酸的糖鞘脂GM3 (NeuGcGM3),由于人体自身不合成Neu5Gc,人体内的Neu5Gc主要是由摄入食物所获得[22]。糖鞘脂GM2与细胞黏附和细胞的迁移相关,高水平表达GM2的小细胞肺癌细胞在小鼠体内表现出向多种组织迁移的倾向,而这种远端转移可以被外援添加GM2的抗体所阻断[23]。在模拟肿瘤发生过程的上皮-间质转化的细胞模型中,用转化生长因子β1处理小鼠乳腺上皮NMuMG细胞,细胞膜上的糖鞘脂四糖基脑酰胺Gg4表达下降[24]。各种肿瘤中表达异常的糖鞘脂如表1所列[25]。
在肿瘤的形成和发展过程中,肿瘤细胞会分泌更多的生长因子,以促进细胞增殖,例如肺癌和卵巢癌细胞转化生长因子分泌量增加。此外,生长因子受体数量会增多,与生长因子受体相关的信号途径被异常激活。一般来讲,生长因子的数量与肿瘤的生长速度呈正相关。例如在腺癌、鳞状上皮细胞癌中表皮生长因子EGF受体ErbB过度表达,在神经胶质细胞瘤中神经生长因子受体显著增加。而各种生长因子都与细胞增生有关,如EGF可促进多种细胞有丝分裂、刺激细胞增生、促进创伤愈合等。研究表明,糖鞘脂与生长因子受体存在密切关系,例如糖鞘脂GM3及其结构类似物可以显著抑制表皮生长因子受体、血小板源生长因子受体、胰岛素受体等多种生长因子受体酪氨酸激酶的活性[26-30] ;GM3 和整合蛋白α5β1互相作用可以稳定依赖于纤维连接蛋白的细胞黏附[31]。表达神经节苷脂GM2、肝细胞生长因子受体c-MET和CD82的上皮细胞在受到肝细胞生长因子的诱导时,细胞生长和细胞迁移没有显著变化。而只表达GM2和c-MET,不表达CD82 的癌细胞在受到肝细胞生长因子的刺激时,细胞生长和细胞迁移大大增加[32]。
5 糖脂类药物及疫苗
单唾液酸四已糖神经节苷脂钠,即神经节苷脂 GM1(钠盐)能穿过血脑屏障进入大脑,直接作用于人脑细胞,镶嵌在受损的神经细胞膜上,稳定和改善神经细胞膜的物质交换功能,通过促进各种形态、生化、组化、神经生理及行为参数的改善,促使凋亡的神经细胞恢复活力。具有促进神经细胞及大脑组织的正常发育、修复损伤神经及大脑组织作用。近年来,其在脑卒中、小儿脑瘫、老年痴呆症及脊髓损伤的广泛使用,进一步带动了医院神经系统用药市场的快速增长。
由于糖鞘脂在肿瘤中异常表达,理论上,阻断这些神经节苷脂的合成途径,即可阻止肿瘤细胞的转移和扩散。例如Lyso-GM3 和Sialyl Sphingosine 对于由GM3 诱导的B16 细胞黏附有显著的抑制作用[33]。识别糖鞘脂GD2的抗体hu14.18K322A,用于治疗神经母细胞瘤,已经处于Ⅱ期临床试验阶段[34]。再如,针对肺癌细胞高表达的糖鞘脂GM2,已开发出特异识别GM2的抗体BIW-8962 [35]。能够对NeuGcGM3 做出特异反应的抗体疫苗racotumomab,能够显著延长肺癌病人的生存时间,经过Ⅱ期和Ⅲ期临床试验后,以氢氧化铝为佐剂,该疫苗已可在一定条件下在一些拉丁美洲国家被应用于非小细胞肺癌的维持治疗[36]。α-半乳糖酰基鞘氨醇(α-GalCer)是NKT (natural killer T)细胞的配体,是NKT细胞的特异性激活剂,介导树突状细胞与NKT细胞的相互作用,已证实α-GalCer具有良好的抑制肿瘤效应,当前已作为抗癌剂用于临床试验中[37]。此外,阻断糖脂Gb3、Gb4和Globo H的表达也被证能够抑制某些肿瘤,因此,这些糖脂相应的抗体疫苗也被应用于肿瘤免疫研究中[38]。
推荐阅读:比较好发表的医学杂志有哪些
6 总 结
糖鞘脂在哺乳动物细胞表面广泛表达,在细胞发育、分化和凋亡等基本过程中发挥着重要作用,与遗传性疾病和神经性疾病以及肿瘤发生发展过程密切。虽然已发现糖鞘脂对于某些疾病、干细胞以及恶性肿瘤等具有一定指征意义,但多数疾病与糖鞘脂异常表达之间具体的因果关系尚不明确。因此,深入研究糖鞘脂的生物合成及分解代谢途径,对了解各种疾病的发病机理,实现疾病的早期诊断和预防,开发相应的糖鞘脂药物或抗体类药物,开展针对性的治疗方案等方面都具有重要意义。
《糖鞘脂的生物学功能及相关药物开发研究》
- 花卉园艺论文盆栽花卉养
- 科技改革论文简析邓小平
- 新闻论文发表媒介终端化
- 内蒙煤炭论文发表分析煤
- 电气自动化技术新发展运
- 中国外语教学期刊征稿目
- 液压与气动杂志2016年目录
- 中级科技职称论文范文:
最新优质论文
- 两三千字论文能发核心吗
- 如何让sci杂志延长修稿时
- 写车床维修论文参考哪些
- 评价期刊质量的指标
- 最新!锡林郭勒盟在全区
- 中国民族博览是艺术类核
- cpci是什么领域论文数据库
- 施工技术期刊发论文要求
论文发表问题热点
- 发表论文有哪些不错的平
- 金属成型方面评职称用论
- 医学学术杂志的常见鉴别
- 吉林职称发一篇论文多少
- 包装设计类期刊哪些收录
- 医学论文准备格式基本要
- 电气方面的职称都有哪些
- 景观设计行业的职称论文












